BRASÍLIA/DF - Agora todos os receituários para prescrição de medicamentos controlados podem ser impressos em gráficas pelos próprios profissionais prescritores e pelas instituições de saúde. A norma foi aprovada pela diretoria colegiada da Agência Nacional de Vigilância Sanitária (Anvisa) no fim do ano passado.
Até então, alguns desses receituários — como os de cor amarela — eram impressos exclusivamente pela autoridade sanitária local. Com a publicação da resolução, a impressão de todos os modelos pode ser feita pelos próprios prescritores e pelas instituições.
Em nota, a Anvisa informou que a medida integra um conjunto de ações de desburocratização e simplificação do acesso da população brasileira a medicamentos e reforçou que a norma não elimina a exigência de impressão nem a obrigatoriedade de numeração fornecida pela autoridade sanitária local.
“Assim, prescritores e instituições devem continuar solicitando previamente essa numeração junto à autoridade sanitária competente e, a partir de 13 de fevereiro, poderão providenciar a impressão dos receituários em gráfica”, destacou a agência no comunicado.
A Anvisa ressaltou ainda que a resolução não altera outras regras estabelecidas por autoridades sanitárias locais. Em caso de dúvidas sobre exigências complementares relacionadas ao procedimento de impressão, a orientação é consultar a autoridade sanitária da respectiva localidade.
De acordo com a agência, os modelos de receituários anteriormente publicados nos anexos da Portaria nº 344/1998 deixam de ser válidos para novas impressões a partir desta sexta-feira. Os novos modelos a serem utilizados podem ser consultados na página do Sistema Nacional de Controle de Receituários (SNCR).
Receituários impressos até 12 de fevereiro de 2026 continuam válidos por tempo indeterminado.
A norma prevê ainda que, até junho, a Anvisa disponibilize uma ferramenta no SNCR que permite a emissão eletrônica de todos os receituários de medicamentos controlados.
“Até a disponibilização dessa funcionalidade, não há mudanças quanto à emissão eletrônica”.
“Para a emissão de notificações de receita em formato eletrônico, será necessário aguardar a implementação da ferramenta”, informou a agência.
AGÊNCIA BRASIL
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) determinou, nesta segunda-feira (2), a interdição cautelar do leite condensado semidesnatado La Vaquita e apreendeu os suplementos Glicojax e Duras.
O lote do leite condensado foi reprovado no teste microbiológico Estafilococos Coagulase Positiva (ECP), após análises fiscais do Laboratório Central de Saúde Pública Noel Nutels. O teste mede a quantidade de bactérias Staphylococcus aureus em alimentos, bebidas e embalagens, que, em níveis elevados, podem causar intoxicações alimentares e outras doenças.
A Anvisa atribuiu o leite condensado La Vaquita à empresa Apti Alimentos, porém, a alimentícia afirmou, em nota oficial, que o produto não faz parte do seu portfólio e que foi associado erroneamente pela agência de vigilância sanitária.
Suplementos
A Anvisa constatou que os suplementos Glicojax e Durasil possuem origem desconhecida e utilizam propagandas enganosas. O Glicojax diz possuir benefícios terapêuticos, como auxílio no controle da glicose sanguínea, suporte cardiovascular, suporte à saúde metabólica e controle da diabetes. Segundo a Anvisa, tais benefícios não apresentam comprovação científica.
Já o suplemento em gotas da marca Durasil promete aliviar dores e melhorar a função erétil. O produto também tem o fabricante desconhecido. Apesar das irregularidades, plataformas de vendas online como Shopee e Mercado Livre continuam a distribuir o suplemento.
AGÊNCIA BRASIL
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou o início do estudo clínico para avaliar a segurança do uso do medicamento polilaminina no tratamento do trauma raquimedular agudo, que é uma lesão da medula espinhal ou coluna vertebral.
No anúncio feito, na segunda (5), o ministro da Saúde, Alexandre Padilha (à esquerda, na foto), destacou que a pesquisa será um marco importante para quem sofreu uma lesão medular e também para as suas famílias.
“Cada avanço científico é sempre uma nova esperança renovada”, disse Padilha.
Pesquisa em universidade pública
O ministro considera que o produto é uma inovação radical e com tecnologia 100% nacional. Os estudos com polilaminina são desenvolvidos por pesquisadores da Universidade Federal do Rio de Janeiro (UFRJ), com a liderança da professora Tatiana Sampaio, em parceria com o laboratório Cristália.
Segundo Padilha, a pesquisa já apresentou resultados promissores na recuperação de movimentos. Nesta primeira fase, o estudo da polilaminina será realizado em cinco pacientes voluntários com lesões agudas da medula espinhal torácica entre as vértebras T2 e T10.
Essas pessoas incluídas no estudo devem ter indicação cirúrgica ocorrida a menos de 72 horas da lesão. Os locais de realização ainda serão definidos pela empresa responsável. Ao longo da estruturação do projeto, o Ministério da Saúde investiu os recursos para a pesquisa básica.
Prioridade
Segundo o diretor-presidente da Anvisa, Leandro Safatle, a aprovação do início do estudo clínico da polilaminina foi priorizada pelo comitê de inovação da agência com o objetivo de acelerar pesquisas e registros de amplo interesse público.
“Uma pesquisa 100% nacional, que fortalece a ciência e saúde do nosso país”, afirmou Leandro Safatle.
A pesquisa com a proteína polilaminina, presente em diversos animais, inclusive nos seres humanos, visa avaliar a segurança da aplicação do medicamento e identificar possíveis riscos para a continuidade do desenvolvimento clínico.
A empresa patrocinadora será responsável por coletar, monitorar e avaliar sistematicamente todos os eventos adversos, inclusive os não graves, garantindo a segurança dos participantes.
AGÊNCIA BRASIL
BRASÍLIA/DF - Os suplementos alimentares de proteína em pó da marca Proteus/Whey Isolate Protein Mix, comercializados pela empresa Unlimited Alimentos e Suplementos SLU Ltda. deverão ser recolhidos do mercado após determinação da Agência Nacional de Vigilância Sanitária (Anvisa), na segunda-feira (10), por falta de regularização e de licenciamento sanitário.

A comercialização, a distribuição, a fabricação, a importação, a divulgação e o consumo dos produtos estão suspensos.
“Os suplementos vêm sendo divulgados e comercializados em sites de vendas online, como Shopee e Mercado Livre, sem ter regularização sanitária. Além disso, não há identificação de fabricante ou importador nacional”, diz a Anvisa.
A Anvisa determinou também o recolhimento dos suplementos alimentares da Bugroon Raízes Indústria e Comércio de Produtos Naturais Ltda. Segundo a agência, a fabricante produz suplementos e óleos da marca sem licenciamento sanitário e comercializa os produtos em seu site oficial. A comercialização, distribuição, fabricação, importação, propaganda e o consumo dos seus produtos não podem ser vendidos.
Os suplementos suspensos são Óleo de Menta Piperita Bugroon; Óleo de Sucupira Bugroon; Óleo de Copaíba Bugroon; Suplemento Alimentar em Cápsulas Ginkocen Bugroon; Suplemento Alimentar em Cápsulas Calmom Bugroon; Suplemento Alimentar em Cápsulas Catux Bugroon; Suplemento Alimentar em Cápsulas Unaro Moringa Bugroon; Suplemento Alimentar em Cápsulas Neuralfocus Bugroon; Suplemento Alimentar em Cápsulas Contradô Bugroon. Todos os lotes estão incluídos na determinação da Anvisa.
AGÊNCIA BRASIL
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a comercialização de produtos à base de cannabis das empresas Hemp Vegan e Cannafy. Também foi alvo de fiscalização da Anvisa a empresa De Volta às Raízes, que vende produtos feitos com cogumelos.

A Resolução 3.987/2025, com a lista de itens vetados, foi publicada no Diário Oficial da União, da última quinta-feira (10).
De acordo com a Anvisa, os produtos da Hemp Vegan não têm registro ou autorização da agência e são “fabricados por empresa desconhecida”. A proibição determinada se aplica a todos os lotes de produtos derivados de cannabis da marca:
- Produtos com Fitocanabinoides (CBG, CBG, CBDA)
- Bálsamos Tópicos de CBD
- Gotas de CBD Fullspectrum Vegano
- CBD Gummies Fullspectrum
- CBD Paste Fullspectrum Vegan
- CBD + CBG Drops - Marca Hemp Vegan
- CBD + CBDA Fullspectrum
- Parches Musculares - 50 mg de CBD
A Agência Brasil entrou em contato com a Hemp Vegan, mas não recebeu retorno. O espaço segue aberto para manifestação da empresa.
Cannafy
Outra empresa alvo da fiscalização foi a Cannafy Serviços de Internet, que comercializa produtos que não possuem registro ou autorização na Anvisa, fabricados por empresa que também não possui autorização de funcionamento na agência.
Estão proibidos todos os lotes dos seguintes produtos:
- Produtos de cannabis da marca CBDM Gummy
- Produtos de cannabis da Marca Canna River
- Produtos de cannabis da Marca Rare Cannabinoid
No site da Cannafy, a empresa informou que não fabrica nem comercializa produtos de cannabis no Brasil e que cumpre rigorosamente toda a legislação brasileira aplicável a esses produtos. “Apenas facilitamos o contato entre pacientes brasileiros e fornecedores estrangeiros, e atuamos para garantir que todas as importações tenham sido previamente autorizadas pela Anvisa, conforme dispõe a Resolução Anvisa RDC n. 660/2022”, diz a nota.
De Volta as Raízes
Por fim, a agência sanitária proibiu a comercialização de todos lotes dos produtos feitos com cogumelos da De Volta às Raízes, “sem registro, notificação ou cadastro na Anvisa” e fabricados por empresa que não possui autorização para fabricação de medicamentos.
Os produtos são os seguintes:
- Cogumelo Tremella
- Cogumelo Reish
- Cordyceps Militaris
- Cogumelo do Sol
- Cogumelo Juba de Leão
- Cogumelo Chaga
- Cogumelo Cauda de Peru
Em seu site, a empresa explica que os cogumelos são utilizados na Medicina Tradicional Chinesa, “mas não se enquadram como medicamentos, portanto, estão dispensados de registro no Ministério da Saúde conforme a Resolução nº 240/2018”.
AGÊNCIA BRASIL
BRASÍLIA/DF - O Brasil não tem registros que relacionem o uso de paracetamol durante a gravidez com casos de autismo. É o que afirmou a Agência Nacional de Vigilância Sanitária (Anvisa), na quarta-feira (24), depois que o presidente dos Estados Unidos, Donald Trump, citou a existência de ligação entre o uso de analgésico na gravidez e o Transtorno do Espectro Autista (TEA).

O caso ganhou repercussão no Brasil, sobretudo entre as mães de crianças com o diagnóstico de autismo. Pelas redes sociais ou em grupos de maternidade, relatos de preocupação e sentimento de culpa.
Para Rayanne Rodrigues, a preocupação maior foi com a “desinformação”. Estudante de Farmácia e mãe de uma criança com autismo nível dois de suporte, ela relata a empatia pelas mulheres que carregam o sentimento de culpa.
"Nós, como mães atípicas, ficamos preocupadas com o tamanho da desinformação que é repassada para frente. Uma mulher grávida já não tem um leque assim muito grande de medicamentos que pode ser tomado durante a gestação", afirmou
"Não é o meu caso, mas tem muitas mães que se culpam pelo filho ter o transtorno, ficam se perguntando o que elas fizeram de errado na gestação. E aí vem uma situação dessa e acaba culpabilizando mais ainda a mãe, sendo que nós não temos culpa. Vários fatores podem ocasionar o autismo", completou Rayanne.
Para tranquilizar a população, o ministro da Saúde, Alexandre Padilha, publicou nas redes sociais um recado sobre a falta de comprovação científica.

O ministro da Saúde, Alexandre Padilha, desmentiu, em suas redes sociais, a afirmação de que o uso de paracetamol durante a gravidez cause autismo nas crianças. Foto: Marcelo Camargo/Agência Brasil
"O Tylenol é causa do autismo? Mentira! Não existe nenhum estudo que comprove uma relação entre o paracetamol e o Tylenol com o autismo. Esse tipo de mentira coloca a sua vida e a vida do seu bebê em risco. A Organização Mundial de Saúde, a Anvisa, as principais agências internacionais de proteção à saúde, já deixaram claro: o paracetamol é medicação segura. Aliás, o autismo foi diagnosticado e identificado muito antes de existir paracetamol."
Repercussão mundial
Após a declaração de Trump, a Organização Mundial da Saúde (OMS) emitiu uma nota relatando que “atualmente não há evidências científicas conclusivas que confirmem” a ligação do autismo e o paracetamol na gravidez. Na nota, a OMS também citou que nenhuma das muitas pesquisas sobre o assunto encontrou associação consistente.
A Agência de Medicamentos da União Europeia também disse que “atualmente não há novas evidências que exijam alterações nas recomendações atuais de uso” do medicamento pela instituição.
Apesar disso, a FDA dos Estados Unidos, agência reguladora equivalente à Anvisa no Brasil, anunciou ter começado o processo para modificar a bula do paracetamol no país, para refletir as supostas evidências, e informou que emitiu alerta para médicos dos Estados Unidos sobre o medicamento.
No Brasil, a Anvisa informa que o paracetamol é classificado em norma como medicamento de baixo risco e, por isso, faz parte da lista de produtos que não exigem receita médica. De acordo com a agência, a liberação de medicamentos no país segue "critérios técnicos e científicos rigorosos” para garantir qualidade, segurança e eficácia. Mesmo assim, esse tipo de remédio passa por monitoramento.
AGÊNCIA BRASIL
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou esta semana o registro do medicamento Voranigo® (vorasidenibe), inibidor de enzimas, disponível no formato de comprimidos de uso diário produzidos pela farmacêutica Servier e utilizados no tratamento de câncer cerebral.
Em nota, a farmacêutica informou que o medicamento é indicado para pacientes a partir dos 12 anos com tipos específicos de gliomas difusos chamados astrocitomas ou oligodendrogliomas, de baixo grau (grau 2), com mutações na enzima IDH 1 ou 2, que já foram submetidos a procedimento cirúrgico e que não tenham indicação de radioterapia ou quimioterapia imediata.
Ainda de acordo com a Servier, o vorasidenibe atua bloqueando as enzimas IDH1 e IDH2 mutadas, responsáveis pela produção de substâncias que estimulam o crescimento de células tumorais.
Em entrevista à Agência Brasil, o oncologista Fernando Maluf avaliou a aprovação do medicamento como o maior avanço na área de gliomas dos últimos 20 anos. “Gliomas são os tumores cerebrais mais comuns que existem. Os de baixo grau acometem preferencialmente uma população muito jovem, que começa a desenvolver esse tumor desde a infância e adolescência até adulto jovem”.
“Os tumores de baixo grau só têm rádio e quimio como alternativas. Essa medicação coloca uma alternativa muito especial para tentar evitar novas cirurgias, radioterapia ou medicamentos mais agressivos. Ela consegue reduzir, de forma muito importante, o risco de progressão da doença às custas de uma boa tolerabilidade”, completou o médico.
AGÊNCIA BRASIL
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) determinou o recolhimento de lotes de polpa de frutas, champignon em conserva e molho de alho de três marcas diferentes, por apresentarem resultados insatisfatórios em laudos emitidos por laboratórios públicos.
Além disso, foi identificada a comercialização de um azeite de origem desconhecida e fora dos padrões estabelecidos, com ordem pela apreensão e suspensão total da vendas.
As medidas sanitárias constam em uma resolução publicada na segunda-feira (7), no Diário Oficial da União (DOU).
A polpa de fruta de morango da marca De Marchi teve o lote 09437-181 (com validade até 01/11/2026) recolhido, após o resultado inconsistente no ensaio pesquisa de matérias estranhas, conforme laudo de análise emitido pelo Laboratório Central de Saúde Pública de Santa Catarina (Lacen/SC).
Também por resultado insatisfatório sobre quantidade de dióxido de enxofre acima do limite permitido, a Anvisa pediu o recolhimento de um lote do Champignon inteiro em conserva, da marca Imperador, fabricado pela Indústria e Comércio Nobre. O lote em questão é o 241023CHI, com data de validade de 10/2026. O laudo foi emitido pelo Lacen-DF.
O molho de alho da marca Qualitá, fabricado pela Sakura Nakaya Alimentos, também teve um lote recolhido, por resultado insatisfatório no ensaio de pesquisa quantitativa de dióxido de enxofre, que se encontra acima do limite permitido, conforme laudo também emitido pelo Lacen-DF. A medida abrange o lote 29, com data de validade de 01/2026.
No caso do azeite extravirgem da marca Vale dos Vinhedos, a determinação da Anvisa é pela apreensão total e proibição da comercialização, distribuição, fabricação, importação, propaganda e uso.
Além do produto ter origem desconhecida, segundo a agência, o laudo de análise apresentou resultado insatisfatório, estando em desacordo com os padrões estabelecidos pela legislação vigente nos ensaios de rotulagem e físico-químico.
A Intralogística Distribuidora Concept, responsável pelo produto, consta com Cadastro Nacional de Pessoa Jurídica (CNPJ) suspenso por inconsistência nos registros da Receita Federal.
A reportagem busca contato com as marcas citadas para obter um posicionamento e incluir na matéria.
AGÊNCIA BRASIL
Dori recolhe lotes de balas com risco de contaminação por Salmonella; Anvisa proíbe venda de produtos
BRASÍLIA/DF - A marca de balas Dori anunciou, na quinta-feira, 22 de agosto, que vai recolher produtos fabricados em Rolândia (PR) no período de 21 de junho a 10 de julho de 2024, "devido a um potencial risco de contaminação com Salmonella muenchen", segundo comunicado da empresa.
Na segunda-feira (19), após ser avisada pela Dori sobre esses possíveis riscos, a Anvisa publicou no Diário Oficial da União uma determinação proibindo a comercialização, a distribuição e o uso de lotes específicos do alimento [veja imagens abaixo].
Segundo a fabricante, os pontos de venda e estabelecimentos varejistas foram orientados a interromper imediatamente a venda dos seguintes produtos (dependendo do lote e da validade), distribuídos nacionalmente:
- Bala Hortelã Recheada 30x600G
- Bala Bolete Tutti Frutti 30x600G
- Bala Hortelã Mint 30x600G
- Bala Morango Recheada 30x600G
- Dori Regaliz Tijolo 16x60G
- Bala Lua Cheia Chantilly 24x600G
- Bala Yogurte100 Morango 24x600G
- Bala Yogurte100 Morango 24x400G
Ainda de acordo com a empresa, "o processo de descontaminação, limpeza e higienização da planta fabril afetada já foi concluído."
O que a contaminação pode provocar?
A ingestão da bactéria Salmonella muenchen pode causar infecção gastrointestinal, cujos sintomas mais comuns são:
- dor abdominal;
- diarreia;
- febre
- e vômito
Orientação aos consumidores
A Dori orienta que os consumidores que já compraram os lotes dos alimentos acima não os consumam e entrem em contato com o serviço de atendimento ao cliente para esclarecer dúvidas sobre o recolhimento e/ou o processo de reembolso.
Telefone: 0800 707 4077, de segunda a sexta-feira, das 8:00 às 17:00 e aos sábados das 8:00 às 12:00
E-mail: Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo..
g1
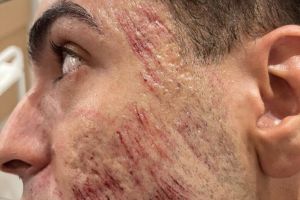
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a importação, fabricação, manipulação, comercialização, propaganda e o uso de produtos à base de fenol em procedimentos de saúde em geral ou estéticos. A resolução foi publicada no Diário Oficial da União.
No início deste mês, um jovem de 27 anos morreu em São Paulo após complicações geradas por um peeling de fenol. O rapaz fez o procedimento em uma clínica estética. A dona do local não tinha especialidade ou autorização para fazer esse tipo de peeling. A polícia investiga o caso como homicídio. A clínica foi interditada e multada.
Em nota, a Anvisa informou que a proibição tem como objetivo zelar pela saúde e pela integridade física da população, “uma vez que, até a presente data, não foram apresentados à agência estudos que comprovem a eficácia e segurança do produto fenol para uso em tais procedimentos”.
“A determinação ficará vigente enquanto são conduzidas as investigações sobre os potenciais danos associados ao uso desta substância química, que vem sendo utilizada em diversos procedimentos invasivos”, completou a Anvisa.
Entenda
O peeling de fenol é um procedimento autorizado no Brasil. De acordo com a Sociedade Brasileira de Dermatologia (SBD), é indicado para tratar envelhecimento facial severo, caracterizado por rugas profundas e textura da pele consideravelmente comprometida.
A técnica - executada de forma correta e seguindo as orientações - traz resultados na produção de colágeno e redução significativa de rugas e manchas. A entidade, entretanto, considera o procedimento invasivo e agressivo e diz que a realização em toda a face demanda extrema cautela.
“É importante ressaltar que o procedimento apresenta riscos e tempo de recuperação prolongado, exigindo afastamento das atividades habituais por um período estendido”, explicou a Anvisa.
O Conselho Federal de Medicina (CFM) defende que procedimentos estéticos invasivos, como o peeling de fenol, sejam feitos apenas por médicos, preferencialmente com especialização em dermatologia ou cirurgia plástica, de forma a garantir ao paciente atendimento com competência técnica e segurança.
O CFM reitera ainda que, mesmo realizado por médicos, todo procedimento estético invasivo deve ser realizado em ambiente preparado, com obediência às normas sanitárias e com estrutura para imediata intervenção de suporte à vida em caso de intercorrências.
A entidade chegou a cobrar providências, por parte de outros órgãos de controle, para coibir abusos e irregularidades na área.
“A Agência Nacional de Vigilância Sanitária (Anvisa), com o apoio das vigilâncias estaduais e municipais, deve reforçar a fiscalização aos estabelecimentos e profissionais que prestam esse tipo de serviço sem atenderem aos critérios definidos em lei e pelos órgãos de controle”.
Por Paula Laboissière – Repórter da Agência Brasil