SÃO PAULO/SP - Anvisa (Agência Nacional de Vigilância Sanitária) determinou recolhimento de diversos lotes dos detergentes Ypê, por risco de contaminação microbiológica em resolução publicada na terça-feira (7). A medida também determina a comercialização e distribuição desses lotes.
A Química Amparo, fabricante do detergente, notificou a Agência e a realização do recolhimento voluntário dos produtos afetados pela possibilidade de contágio.
Em nota, a empresa afirma que a medida foi realizada devido a possibilidade de descaracterização do odor tradicional do produto de limpeza, não apresentando risco à saúde do consumidor, somente possível mudança no cheiro.
As linhas de detergentes afetadas foram as de limão, maçã, neutro, capim limão, coco, clear care.
A resolução também determina que todas unidades produzidas de julho a dezembro de 2022, desde que tenham o lote com final 1 e 3 sejam suspensas. Estão incluídos detergentes de todos os tipos.
A Química Amparo afirma que objeto da ação voluntária de recolhimento haviam sido detectados pelo controle de qualidade da própria empresa que comunicou à agência reguladora e iniciou o recolhimento dos itens há mais de um mês.
Importante destacar que não há proibição de comercialização do produto e sim o bloqueio e recolhimento exclusivamente dos lotes específicos indicados na ação voluntária proposta pela própria empresa.
VEJA OS LOTES ATINGIDOS PELA SUSPENSÃO
Versão Ypê Clear Care
172051, 179054, 184054, 185054, 186054, 228054, 233011, 234011, 235011, 236011, 242054, 253011, 255011, 267051, 269051, 270051, 278011, 279011, 280011, 281011, 282011, 283011, 302051, 303051, 304051, 314011, 315011, 316011 e 318011.Versão Ypê Coco
029016, 030016, 036016, 038016, 057016, 058016, 148051, 149051, 151051, 212044, 213051, 215051, 216051, 217051, 218051, 219051, 220051, 221051, 228054, 232051, 233051, 236051, 238051, 243044, 248051, 249051, 256051, 257051, 258051, 272051, 273051, 274051, 275051, 276051, 277051, 284051, 286051, 288051, 289051, 290051, 291051, 298051, 299051, 300051, 301051, 317016, 331051, 333051, 33405, 031016, 188031, 225081, 226081, 227081, 239081, 270031, 281031, 282031, 283031, 295031, 323016, 324016, 327031, 328031, 329031 e 330031.Versão Ypê Capim Limão
225031, 226031, 242081, 314031, 323081, 325081, 060016, 173081, 174081, 175081, 176081, 177081, 178081, 223011, 224011, 239051, 240051, 242051, 271081, 272081, 273081, 299011, 300011, 302011, 303011, 326051, 327051, 336016, 337016, 338016, 346016 e 347016.Versão Ypê Limão
031016, 040016, 041016, 042016, 043016, 127011, 129011, 130011, 134081, 135081, 136081, 137081, 138081, 148011, 149011, 150011, 218011, 219011, 310011, 311011, 319016, 332016, 339016, 347016, 053016, 054016, 141031, 221081, 222081, 223081, 227081, 228081, 229081, 279081, 280081, 288031, 315031 e 325016.Versão Ypê Maçã
010016, 011016, 012016, 026016, 028016, 029016, 054016, 131011, 132011, 134011, 142011, 173011, 174011, 187011, 188011, 189011, 193011, 194011, 195011, 200051, 213011, 220011, 221011, 228011, 229011, 230011, 241011, 242011, 248081, 249081, 256011, 257011, 262011, 263011, 264011, 265011, 266011, 278061, 279061, 280061, 281061, 282061, 283051, 292011, 293011, 295011, 311011, 312011, 313011, 313061, 327011, 327016, 328011, 328016, 329011, 330011, 357016, 046016, 047016, 185081, 186081, 191081, 192081, 204101, 223081, 224081, 232081, 234081, 268031, 269031, 309031 e 310031.Versão Ypê Neutro
019056, 020056, 037056, 038056, 039056, 054056, 055056, 173001, 174001, 186064, 188001, 211001, 212001, 225001, 226001, 228001, 228064, 237001, 239001, 272056, 320001, 321001, 322001, 324056, 325001, 325056, 326001, 326056, 327001, 331056, 336056, 338056, 356056, 236001, 016016, 017016, 024016, 025016, 026016, 038016, 039016, 040016, 172081, 172151, 173151, 174151, 175151, 176151, 177151, 178151, 188151, 207151, 208151, 209151, 210151, 211081, 212081, 225011, 226011, 227011, 228151, 229151, 230151, 232151, 233151, 234051, 234151, 235051.,235151, 236151, 239011, 241151, 279151, 282151, 283151, 317151, 318016, 318151, 321011, 322011, 325151, 326151, 327151, 328151, 333016, 342016, 346016, 349016, 048016, 049016, 050016, 051016, 176031, 177031, 207031, 208031, 227031, 229031, 236031, 237031, 238031, 282081, 316031, 317031, 318031, 319031, 323031, 325031, 326016, 327031, 353016, 355016, 052016, 171031, 173031, 174031, 209031, 230031, 232031, 233031, 234031, 235031, 239031 e 327016.
POR FOLHAPRESS
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu nesta sexta-feira (19) por manter a proibição aos cigarros eletrônicos no Brasil. Com isso, continua proibida a comercialização, fabricação e importação, transporte, armazenamento e propaganda desses produtos. Os cinco diretores votaram para que a vedação, em vigor desde 2009, continue no país.

Os dispositivos eletrônicos para fumar (DEFs), conhecidos como cigarros eletrônicos, são chamados também de vape, pod, e-cigarette, e-ciggy, e-pipe, e-cigar e heat not burn (tabaco aquecido).
Com a decisão, a Anvisa informa que qualquer modalidade de importação desses produtos fica proibida, inclusive para uso próprio ou na bagagem de mão do viajante.
De acordo com a agência, a norma não trata do uso individual, porém veda o uso dos dispositivos em ambiente coletivo fechado. O não cumprimento é considerado infração sanitária e levará à aplicação de penalidade, como advertência, interdição, recolhimento e multa.
Dados do Inquérito Telefônico de Fatores de Risco para Doenças Crônicas Não Transmissíveis em Tempos de Pandemia (Covitel 2023) revelam que 4 milhões de pessoas já usaram cigarro eletrônico no Brasil, apesar de a venda não ser autorizada.
Relator
O diretor-presidente da Anvisa e relator da matéria, Antonio Barra Torres, votou favorável à manutenção da proibição desses dispositivos.
“O que estamos tratando, tanto é do impacto à saúde como sempre fazemos, e em relação às questões de produção, de comercialização, armazenamento, transporte, referem-se, então, à questão da produção de um produto que, por enquanto, pela votação, que vamos registrando aqui vai mantendo a proibição”.
Antonio Barra Torres leu por cerca de duas horas pareceres de 32 associações científicas brasileiras, os posicionamentos dos Ministérios da Saúde, da Justiça e Segurança Pública e da Fazenda e citou a consulta pública realizada entre dezembro de 2023 e fevereiro deste ano, mesmo que os argumentos apresentados não tenham alterado as evidências ratificadas pela diretoria em 2022.
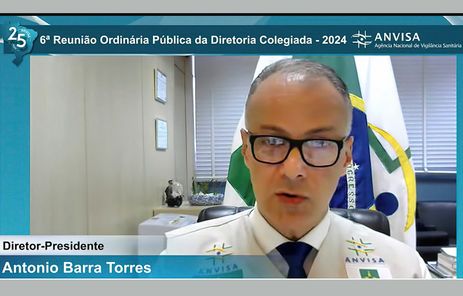
Presidente da Anvisa, Antonio Barra Torres, vota pela manutenção de proibição de cigarros eletrônicos. Foto: Youtube/Anvisa
Em seu relatório, Barra Torres se baseou em documentos da Organização Mundial de Saúde (OMS) e da União Europeia, em decisões do governo da Bélgica de proibir a comercialização de todos os produtos de tabaco aquecido com aditivos que alteram o cheiro e sabor do produto. Ele citou que, nesta semana, o Reino Unido aprovou um projeto de lei que veda aos nascidos após 1º de janeiro de 2009, portanto, menores de 15 anos de idade, comprarem cigarros.
Ele mencionou ainda que a agência federal do Departamento de Saúde e Serviços Humanos dos Estados Unidos (U.S Food and Drug Administration) aponta que, mesmo com a fiscalização, há comércio ilícito desses produtos.
O diretor ainda apresentou proposições de ações para fortalecimento do combate ao uso e circulação dos dispositivos eletrônicos de fumo no Brasil.
Continua depois da publicidade
Manifestações pela proibição
Durante a reunião da diretoria da Anvisa, foram ouvidas diversas manifestações a favor e contra a manutenção da proibição do consumo de dispositivos eletrônicos para fumar no Brasil. Foram exibidos 80 vídeos de pessoas físicas e jurídicas de diversas nacionalidades.
A maior parte dos argumentos favoráveis à manutenção da proibição foram relativos aos danos à saúde pública. A secretária da Comissão Nacional para a Implementação da Convenção-Quadro para o Controle do Tabaco e seus Protocolos (Coniq) da Organização Mundial da Saúde (OMS), Adriana Blanco, manifestou preocupação com a saúde pública dos países que liberaram o consumo destes produtos e com o marketing estratégico da indústria do tabaco, especialmente com o aumento do consumo por jovens.
“Ainda não temos uma resposta clara sobre os impactos do longo prazo de utilização dos DEFs ou da exposição a seus aerossóis, mas as evidências já nos mostram que não são isentos de riscos e que são prejudiciais à saúde humana, especialmente para crianças, jovens e grupos vulneráveis.”
A representante da Organização Pan-Americana da Saúde/Organização Mundial da Saúde (OPAS/OMS), no Brasil, Socorro Gross, apontou que o Brasil é reconhecido internacionalmente pela política interna de controle do tabaco desde o século passado. “Essa medida protege, salva vidas, promove efetivamente a saúde pública e é um passo crucial para um ambiente mais saudável e seguro para todas as pessoas”.
O presidente do Conselho Nacional de Secretarias Municipais de Saúde (Conasems), Hisham Mohamad, fez comparações sobre a piora da situação epidemiológica e o incremento do contrabando em alguns dos mais de 100 países onde a comercialização do produto foi liberada. “Constatamos um grande número de dependência especialmente das novas formas de nicotina que a indústria tem empregado. E em localidades onde foram liberados, como nos Estados Unidos, a maior parte vendida no comércio é de produtos ilegais”.
O ex-diretor da Anvisa e ex-ministro da Saúde (2006-2007) José Agenor Álvares da Silva, relembrou o contexto em que o Brasil conseguiu banir a adição de flavorizantes que favorecem a adesão da população jovem ao fumo e inviabilizou a propaganda dos produtos fumígenos nos pontos de venda. “A Anvisa, que tanto deu exemplo na condução da discussão sobre as vacinas contra a Covid, tem agora uma oportunidade clara de mostrar para o Brasil e para o mundo o seu compromisso com a saúde pública do povo brasileiro”, fez o apelo à diretoria da agência.
A diretora de análise epidemiológica e vigilância de doenças não transmissíveis do Ministério da Saúde, Letícia de Oliveira Cardoso, apontou que não existem estudos científicos que comprovem que os cigarros eletrônicos protegem, substituem ou amenizam os efeitos nocivos dos cigarros normais “Tanto os cigarros eletrônicos como os cigarros convencionais de tabaco apresentam riscos à saúde e não devem ser consumidos pela população. Esta precisa ser informada sobre os riscos de dispositivos eletrônicos de fumar”.
O ex-fumante Alexandre Carlos Vicentini deu seu depoimento sobre como ficou viciado no produto. “Além das várias cores e sabores, o pior de tudo é o teor de nicotina que tem dentro desses aparelhinhos. O que é simplesmente um fator de dependência terrível para mim.”
Contra a proibição
Também foram apresentados argumentos pedindo a regulamentação do consumo pela Anvisa e pela venda dos produtos, apontando a redução de danos aos fumantes de cigarro comum, combate à venda de ilegal de produtos irregulares, sem controle toxicológico e de origem desconhecida. A gestora nas áreas de assuntos regulatórios, qualidade e logística Alessandra Bastos Soares defendeu a regulamentação adequada ao consumo de cigarros eletrônicos para que os consumidores que decidiram pelo uso possam fazê-lo em segurança. “Desejo que, no futuro, nenhum cidadão levante o seu dedo em riste acusando a Anvisa de omissão por não ter uma regra adequada para cuidar de um tema que já é tratado como pandemia do Vape”, alertou.
Já o diretor da British American Tobacco (BAT) - Brasil, anteriormente conhecida como Souza Cruz, Lauro Anhezini Júnior, afirmou que consumidores estão sendo tratados como cidadãos de segunda classe. O representante da indústria de cigarros brasileira pediu que as decisões sejam tomadas com base na ciência. "Não é a ciência apenas da indústria, é a ciência independente desse país que também comprova que se tratam de produtos de redução de riscos. Cigarros eletrônicos são menos arriscados à saúde do que continuar fumando cigarro comum".
O diretor de Comunicação da multinacional Philip Morris Brasil (PMB), Fabio Sabba, defendeu que a atual proibição dos DEFs tem se mostrado ineficaz frente ao crescente mercado ilícito e de contrabando no país. “Ao decidir pela manutenção da simples proibição no momento que o mercado está crescendo descontroladamente, a Anvisa deixa de cumprir o seu papel de assegurar que esses 4 milhões de brasileiros ou mais consumam um produto enquadrado em critérios regulatórios definidos. É ignorar que o próprio mercado está pedindo regras de qualidade de consumo”.
Além de representantes da indústria de tabaco, houve manifestações de proprietários de casas noturnas, bares e restaurantes e de usuários dos cigarros eletrônicos. O representante da Livres, uma associação civil sem fins lucrativos delicada à promoção da liberdade individual, Mano Ferreira, condenou a proibição anterior que não conseguiu erradicar o consumo desses produtos e, ao contrário, impulsionou o mercado ilegal e informal, especialmente entre os jovens. “Uma regulamentação eficaz permitiria não apenas uma fiscalização mais vigorosa, excluindo os produtos mais perigosos do mercado, mas também facilitaria a transição de fumantes tradicionais para alternativas menos nocivas”.
O usuário de vapes Preslei Aaron Bernardo Ribeiro, de 36 anos, garante perceber melhora em seu quadro geral de saúde. “Por 20 anos, fui fumante e utilizei métodos tradicionais, mas não consegui cessar o meu tabagismo. Mas, com o uso do cigarro eletrônico, consegui parar de fumar o cigarro tradicional de uma forma muito eficiente, rápida e fácil”.
A preocupação do presidente da Associação Brasileira de Bares e Casas Noturnas, Fábio Bento Aguayo, foi a dominação do comércio desse produto pelo crime organizado, facções criminosas e milícias. “O estado brasileiro deixa de ganhar, deixa de arrecadar recurso [com tributos] para combater essas atividades ilegais. Brigamos pela regulamentação para defender a sociedade para ter um produto que tem a garantia sobre a procedência dele”.
Histórico
Desde 2009, uma resolução da Anvisa proíbe a comercialização dos dispositivos eletrônicos para fumar no Brasil. Porém, produtos ilegais podem ser adquiridos pela internet, em estabelecimentos comerciais regularizados e pelas mãos de ambulantes mesmo com a proibição de venda. O consumo, sobretudo entre os jovens, tem aumentado.
Em fevereiro deste ano, a Anvisa encerrou a consulta pública para que a sociedade pudesse contribuir para o texto sobre a situação de dispositivos eletrônicos para fumar no Brasil. A proposta de resolução colocada em discussão pela agência foi a de manutenção da proibição já existente. Durante a consulta pública, foram enviadas 13.930 manifestações, sendo 13.614 de pessoas físicas e 316 de pessoas jurídicas. Deste total, contribuições de fato, com conteúdo, aos dispositivos propostos pelo texto da consulta pública, foram 850.
Em 2022, a Anvisa aprovou, por unanimidade, relatório técnico que recomendou a manutenção das proibições dos Dispositivos Eletrônicos para Fumar (DEF) no Brasil e a adoção de medidas para melhorar a fiscalização para coibir o comércio irregular, bem como a conscientização da população sobre os riscos destes dispositivos.
O que são
Desde 2003, quando foram criados, os equipamentos passaram por diversas mudanças. Os dispositivos eletrônicos para fumar (DEFs) envolvem diferentes equipamentos, tecnologias e formatos, tais como cigarros eletrônicos com sistema aberto (onde a pessoa manipula os líquidos a serem utilizados), com sistema fechado (refis padronizados e fechados), com tabaco aquecido (dispositivo eletrônico utilizado com refil de folhas de tabaco), com sistema fechado tipo pod (semelhantes a pen drives), e vaporizadores de ervas, dentre outros.
A maioria dos cigarros eletrônicos usa bateria recarregável com refis. Estes equipamentos geram o aquecimento de um líquido para criar aerossóis (popularmente chamados de vapor) e o usuário inala o vapor.
Os líquidos (e-liquids ou juice) podem conter ou não nicotina em diferentes concentrações, além de aditivos, sabores e produtos químicos tóxicos à saúde, como que contém, em sua maioria, propilenoglicol, glicerina, nicotina e flavorizantes.
No site da Anvisa, é possível ter mais informações sobre os cigarros eletrônicos.
Por Daniella Almeida - Repórter da Agência Brasil
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, no inicio da semana, o registro de uma vacina indicada para a prevenção da doença do trato respiratório inferior causada pelo vírus sincicial respiratório (VSR). Trata-se do principal vírus causador de bronquiolite. O imunizante aprovado é registrado como Arexvy, produzido pela empresa GlaxoSmith Kline.
A vacina foi aprovada pela Anvisa para uso em adultos com 60 anos de idade ou mais. Ela é aplicada de forma intramuscular, em dose única. Ainda de acordo com a agência, a tecnologia utilizada para a vacina é de proteína recombinante, quando uma substância semelhante à presente na superfície do vírus é fabricada na indústria e utilizada para estimular a geração de anticorpos, responsáveis pela imunidade.
"O pedido de registro do medicamento foi enquadrado como prioritário, nos termos da Resolução da Diretoria Colegiada (RDC) 204/2017, por se tratar de condição séria debilitante. Além disso, é uma doença de grande impacto público, principalmente pela faixa etária atingida, que possui grande índice de hospitalizações causadas por infecção pelo VSR", destacou a Anvisa, em nota.
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a composição de vacinas contra influenza que serão utilizadas no Brasil em 2024. Em nota, o órgão destacou que a mudança da composição de cepas ou tipos de vírus da vacina contra influenza é considerada fundamental para a eficácia da dose porque o vírus se adapta e sofre mutações.
“A Organização Mundial da Saúde (OMS) analisa regularmente todos os subtipos do vírus da gripe que circulam com maior frequência para melhorar a eficácia da imunização”, citou o comunicado da agência.
Acrescentou que, “em conformidade com as recomendações da OMS, todos os anos a Anvisa publica a composição das vacinas contra influenza que serão utilizadas no ano seguinte.”
Cepas definidas
Para 2024, as vacinas trivalentes produzidas a partir de ovos de galinha devem usar as seguintes cepas:
- Influenza A/Victoria/4897/2022 (H1N1)pdm09.
- Influenza A/Thailand/8/2022 (H3N2).
- Influenza B/Austria/1359417/2021 (B/linhagem Victoria).
Para as vacinas não baseadas em ovos, a cepa do vírus A (H1N1) deve ser um vírus similar ao vírus influenza A/Wisconsin/67/2022 (H1N1)pdm09. A cepa A (H3N2) deve ser um vírus similar ao vírus influenza A/Massachusetts/18/2022 (H3N2), juntamente com a cepa B.
Já as vacinas quadrivalentes devem conter, além dos três tipos de cepas obrigatórios, um vírus similar ao vírus Influenza B/Phuket/3073/2013 (B/linhagem Yamagata).
Por Paula Laboissière – Repórter da Agência Brasil
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou na segunda-feira (25) um novo medicamento para tratamento de diabetes tipo 2. O Mounjaro, da farmacêutica Eli Lilly, tem como princípio ativo a tirzepatida, que age no controle do açúcar no sangue em adultos com a doença, combinado com dieta e exercícios físicos. O remédio está disponível em formato de caneta injetável.
De acordo com a Anvisa, estudos mostram que a tirzepatida reduz de forma significativa a quantidade de hemoglobina glicada no sangue, o que indica o controle de açúcar. Essa redução contribui para queda do risco de doença microvascular, cegueira, insuficiência renal e amputação de membros.
“Outro benefício dessa droga é a mudança favorável do peso corporal (perda de peso), uma vez que o sobrepeso e a obesidade contribuem para a fisiopatologia do DM2 [diabetes tipo 2]”, informa publicação da Anvisa
A tirzepatida funciona como o primeiro receptor de dois hormônios produzidos no intestino: o polipeptídeo insulinotrópico dependente de glicose (GIP) e o peptídeo-1 semelhante ao glucagon (GLP-1). Com isso, aumenta a quantidade de insulina produzida pelo pâncreas, ajudando no controle glicêmico no sangue.
Diabetes tipo 2
Estima-se que quase 463 milhões de pessoas no mundo, de 20 a 79 anos, têm diabetes. Desse total, o diabetes tipo 2 é responsável por quase 90% dos casos. No Brasil, são quase 17 milhões de adultos com a doença.
A doença é caracterizada pela produção insuficiente de insulina, hormônio que mantém o metabolismo da glicose. É uma das principais causadoras de insuficiência renal, cegueira, amputação e doença cardiovascular, complicações que podem levar à morte.
Pelas projeções, 578,4 milhões de pessoas estarão vivendo com diabetes em 2030, e mais de 700 milhões em 2045. O aumento está relacionado à tendência crescente de obesidade da população, alimentação não saudável e falta de atividade física.
Por Carolina Pimentel – Repórter da Agência Brasil
BRASÍLIA/DF - A empresa Pfizer protocolou na segunda-feira (28) na Agência Nacional de Vigilância Sanitária (Anvisa) um pedido de registro de vacina contra o vírus sincicial respiratório (VSR), causador de infecções no trato respiratório, especialmente a bronquiolite.
A vacina, comercialmente denominada Abrysvo, tem sugestão de indicação de uso em crianças, gestantes e adultos acima de 60 anos. Já está em análise pela agência um pedido de registro de vacina contra o VSR da empresa GlaxoSmith Kline, denominada Arexvy.
A Anvisa irá avaliar a relação benefício/risco do produto, por meio de estudos clínicos e outros dados que comprovem a qualidade, segurança e eficácia da vacina. Se o registro for aprovado, a vacina poderá ser comercializada, distribuída e utilizada pela população, conforme a indicação estabelecida na bula.
A análise de vacinas pela Anvisa é feita de forma conjunta, por três áreas distintas: a área de Produtos biológicos, que avalia os aspectos de qualidade, segurança e eficácia; a área de Farmacovigilância, responsável pelo monitoramento e planos de acompanhamento da vacina após sua entrada em uso no país e a área de Inspeção e Fiscalização, responsável pela avaliação das Boas Práticas de Fabricação.
Bronquiolite
A bronquiolite é uma inflamação da porção terminal dos brônquios que atinge com maior preocupação crianças pequenas e bebês. Atualmente, não há medicamento com indicação preventiva disponível no país.
De acordo com o Ministério da Saúde, entre janeiro e abril de 2022, foram notificados cerca de 3,6 mil casos de Síndrome Respiratória Aguda Grave (SRAG), causados pelo vírus sincicial. A maior parte dos casos ocorreu em crianças menores de 4 anos.
Por Sabrina Craide - Repórter da Agência Brasil
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, na segunda-feira, o registro definitivo da vacina Comirnaty bivalente contra a covid-19 da Pfizer.
O imunizante está indicado para a prevenção da covid-19 e pode ser utilizada por pessoas a partir de 5 anos de idade. A indicação é que o uso seja apenas como dose de reforço, ou seja, só pode ser aplicada em quem já se vacinou contra a doença, com aplicação pelo menos três meses após a última dose tomada.
A vacina já estava sendo utilizada no Programa Nacional de Imunizações (PNI) do Ministério da Saúde (MS) de forma emergencial. Antes do registro definitivo, o produto era usado como dose de reforço para o público acima de 12 anos de idade com comorbidades e para maiores de 18 anos.
Bivalente
De acordo com a Anvisa, vacinas bivalentes dão maior proteção contra a doença, pois contêm uma mistura de cepas do vírus Sars-CoV-2. A Comirnaty bivalente é elaborada com a variante original, que é a cepa Wuhan, somada a uma variante de circulação mais recente, a cepa Ômicron.
No cenário internacional de regulação, a Comirnaty bivalente já tem uso autorizado pela Agência Europeia de Medicamentos (European Medicines Agency – EMA) e pela agência reguladora dos Estados Unidos (Food and Drug Administration – FDA).
Por Daniella Longuinho - Repórter da Rádio Nacional
BRASÍLIA/DF - Em decisão publicada no Diário Oficial da União de quarta-feira (5), a Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a venda, distribuição, fabricação e utilização do lote 22992 de sal da marca própria do Carrefour.
Segundo a Anvisa, o sal obteve um resultado insatisfatório para o teor de iodo (abaixo do limite estabelecido por lei).
O iodo é acrescentado ao sal para evitar doenças, como o bócio, que aumenta o volume da tireoide, glândula localizada no pescoço.
O Carrefour informou que realiza “análises recorrentes” em todos os produtos de marca própria.
Segundo a empresa, “o produto citado foi testado em maio deste ano, e, na ocasião, as amostras analisadas estavam dentro dos parâmetros estabelecidos pela Anvisa”.
O grupo ressaltou ainda que solicitou imediatamente a retirada do produto de todas as lojas onde há estoque e que está “em contato com o fornecedor para apurar o fato”.
por Diego Sousa / ISTOÉ DINHEIRO
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) publicou resolução que permite a utilização de medicamentos e vacinas autorizados para uso emergencial durante a pandemia de covid-19. 

Em nota, a agência destacou que, com o fim da emergência de saúde pública de importância nacional, a norma que estabelecia regras para concessão e manutenção das autorizações de uso emergencial perdeu a vigência.
Comercialização
“Para que medicamentos e vacinas aprovados por meio dessas autorizações ainda possam ser utilizados, a Anvisa publicou a nova norma, permitindo o uso, a distribuição e a comercialização desses produtos, desde que tenham sido fabricados até o último dia 21 de maio”, esclarece a decisão.
A nova resolução reconhece que os medicamentos e as vacinas mantêm sua eficácia e segurança e seguem com avaliação positiva na relação benefícios x riscos. Confira a lista abaixo:
- vacina Comirnaty bivalente BA.1
- vacina Comirnaty bivalente BA.4/BA.5
- vacina CoronaVac
- medicamento Sotrovimabe e Lagevrio (molnupiravir)
- medicamento Paxlovid (nirmatrelvir + ritonavir)
Ainda segundo a Anvisa, para que continuem a ser fabricados após 21 de maio, esses produtos precisam ter seu registro definitivo solicitado pelas empresas.
“Até o momento, as vacinas CoronaVac e Comirnaty bivalente BA.4/BA.5, além do medicamento Paxlovid, já possuem pedido de registro em análise”, finalizou a Anvisa.
Por Paula Laboissière – Repórter da Agência Brasil
Anvisa libera fabricação de produtos da marca Fugini
BRASÍLIA/DF - A Agência Nacional de Vigilância Sanitária (Anvisa) revogou, na 2ªfeira (10), a resolução que suspendia a fabricação, comercialização, distribuição e o uso de todos os alimentos em estoque fabricados pela Fugini Alimentos Ltda.
De acordo com a Anvisa, a revogação foi publicada após a empresa passar por nova inspeção sanitária conduzida pelo Centro de Vigilância Sanitária de São Paulo e pela vigilância sanitária municipal entre os dias 3 e 5 de abril.
“A equipe avaliou as reformas no estabelecimento e as adequações em seus procedimentos de modo a cumprir com as determinações da vigilância sanitária. O estabelecimento foi considerado apto para retomar a fabricação de seus produtos na unidade de Monte Alto, no estado de São Paulo.
Já o processo de fabricação que contêm ingredientes alergênicos, de acordo com a agência, ainda precisa ser adequado para impedir a contaminação entre produtos. Também é necessária avaliação complementar da documentação de controle de qualidade dos produtos em estoque para obter mais informações sobre a segurança e a qualidade.
Seguem mantidas, portanto, a suspensão da fabricação de produtos com ingredientes alergênicos e a distribuição, comercialização e o uso de itens acabados em estoque da empresa fabricados até o dia 27 de março de 2023, além de polpas de tomate utilizadas como matéria-prima, fabricadas ou adquiridas até essa data.
Entenda
Em março, a Fugini passou por inspeção conjunta realizada entre Anvisa, Centro de Vigilância Sanitária de São Paulo e vigilância sanitária municipal, quando foram verificadas falhas consideradas graves no cumprimento das Boas Práticas de Fabricação e, por isso, as atividades da empresa foram suspensas.
“Até o momento, a empresa Fugini cumpriu grande parte das determinações da autoridade sanitária, adequou rapidamente sua planta fabril e seu processo de fabricação, podendo retomar parte da fabricação no local”, informou a Anvisa, em Brasília.
As chamadas Boas Práticas de Fabricação são um conjunto de procedimentos a serem seguidos por empresas fabricantes de alimentos, necessárias para garantir a qualidade sanitária desses produtos.
Elas englobam uma série de regras relacionadas à fabricação de um alimento e abrangem desde as condições físicas e higiênico sanitárias das instalações até o controle de qualidade das matérias primas e do produto final, passando também por questões como saúde e capacitação dos trabalhadores, controle de pragas, armazenamento, transporte, documentação, dentre outros.
Por Paula Laboissière – Repórter da Agência Brasil